रासायनिक बंध किसे कहते हैं?
परमाणु का स्वतंत्र रूप में पाया जाना संभव नहीं है, वे किसी न किसी रूप में
संयुक्त अवस्था में पाये जाते हैं। परमाणओं के परस्पर संयोग से अणुओं का निर्माण होता
है। किसी अणु में उपस्थित परमाणुओं के मध्य आकर्षण पाया जाता है जिसे रासायनिक
बंध कहते हैं। चूंकि परमाणु बंधित अवस्था में अधिक स्थायी होते हैं इसलिए यह स्पष्ट
होता है कि बंधित अवस्था में स्थितिज ऊर्जा परमाणुओं की स्वतंत्र अवस्था में ऊर्जा से
कम होती है। इसी प्रकार रासायनिक आबंध प्रक्रिया में भी ऊर्जा की कमी होती है, अर्थात्
स्थायित्व बढ़ता है, इस कारण परमाणु परस्पर रासायनिक रूप से आबंधित रहते हैं एवं
रासायनिक बंध बनाते हैं।
अक्रिय गैसों को छोड़कर अन्य जितने भी तत्व हैं उनकी बाह्यतम कक्षा में 8 से कम इलेक्ट्रॉन रहते हैं। ये सभी तत्व अक्रिय गैसों की भांति अपनी बाह्यतम कक्षा मेंं स्थायी अष्टक प्राप्त कर लेने की प्रवृत्ति रखते हैं। तत्वों की यह प्रवृत्ति दूसरे तत्व से इलेक्ट्रॉन लेकर या उसको इलेक्ट्रॉन देकर या उनके बीच इलेक्ट्रॉनों का साझा होने से पूरी होती है। यही कारण है कि तत्वों के बीच रासायनिक संयोग होता है।
दो या अधिक परमाणुओं के बीच इलेक्ट्रॉनों का पुनर्वितरण होने से अणुओं का निर्माण होता है। इलेक्ट्रॉनों का यह पुनर्वितरण तीन प्रकार से हो सकता है, अत: बंध तीन प्रकार के होते हैं।
जैसे -
अ. पूर्ण ऊष्मा ऊध्र्वपातन- ठोस सोडियम से गैसीय सोडियम परमाणु
NA(S)→NA(g) H=108.7kjmol-1
ब. आयनन एन्थैल्पी- गैसीय सोडियम परमाणु से सोडियम आयन
NA(S)→NA+(g)+e- H=493.8kjmol-1
स. वियोजन ऊर्जा- गैसीय क्लोरीन अणु से क्लोरीन परमाणु
1/2 CI2(g)→CI(g) H=-120.9kjmol-1
द. गैसीय क्लोरीन परमाणु का क्लोराइड आयन में परिवर्तन (इलेक्ट्रॉन का संकलन)
CI(g)+e-→CI- (g) H=-379.5kjmol-1
इ. सोडियम और क्लोराइड आयन से NaCl निर्माण (क्रिस्टल या जालक का बनना)
Na+(g)+CI- (g)→Na+CI-(S) H=-754.8kjmol-1
इस चरण में उत्सर्जित ऊर्जा जालक ऊर्जा कहलाती है। नैट क्रिया होगी
Na+(s)+1/2CI- (g)→Na+CI- (S) H=--410.9kjmol-1
संभवन की पूर्ण ऊष्मा में परिर्वतन का परिकलन अन्य ऊर्जाओं का योग में परिवर्तन को लेकर किया जा सकता है।
H=(180 .7+493.8+120.9-379.5-754.8)=--410 .9kjmol-1
अत: हम देख सकते हैं कि सोडियम और क्लोरीन से NaCl बनने का प्रक्रम ऊर्जा को काफी कम कर देता है। यह युक्ति ऊर्जा के संरक्षण नियम का पालन करती है और यह बार्न हॉबर चक्र कहलाती है।
इसमें सम्मिलित पाँच विभिन्न प्रकार की ऊर्जाओं मेंं से दो (पूर्ण ऊष्मा ऊध्र्वपातन और वियोजन ऊर्जा) का मान बाकियों से कम होता है। इसलिए बाकी तीन ऊर्जा- आयनन एन्थैल्पी, इलेक्ट्रान बन्धुता और जालक ऊर्जा एक आयनिक यौगिक के बनने में महत्वपूर्ण भूमिका निभाती हैं। उपर्युक्त चर्चा के बाद हम कह सकते हैं कि आयनिक यौगिकों का बनना सुगमता से सम्भव होता है। यदि-
अक्रिय गैसों को छोड़कर अन्य जितने भी तत्व हैं उनकी बाह्यतम कक्षा में 8 से कम इलेक्ट्रॉन रहते हैं। ये सभी तत्व अक्रिय गैसों की भांति अपनी बाह्यतम कक्षा मेंं स्थायी अष्टक प्राप्त कर लेने की प्रवृत्ति रखते हैं। तत्वों की यह प्रवृत्ति दूसरे तत्व से इलेक्ट्रॉन लेकर या उसको इलेक्ट्रॉन देकर या उनके बीच इलेक्ट्रॉनों का साझा होने से पूरी होती है। यही कारण है कि तत्वों के बीच रासायनिक संयोग होता है।
दो या अधिक परमाणुओं के बीच इलेक्ट्रॉनों का पुनर्वितरण होने से अणुओं का निर्माण होता है। इलेक्ट्रॉनों का यह पुनर्वितरण तीन प्रकार से हो सकता है, अत: बंध तीन प्रकार के होते हैं।
- आयनिक या वैद्युत संयोजक आबंध
- सहसंयोजक आबंध
- उपसहसंयोजक आबंध
आयनिक या वैद्युत संयोजक आबंध
परमाणुओं के मध्य इलेक्टा्रॅनों के अदान पद्रान से जो बंध बनते हैं उन्हें विद्युत संयोजी अथवा आयनिक बंध कहते हैं। जो परमाणु इलेक्ट्रॉन ग्रहण करता है उस पर ऋण-आवेश और जो इलेक्ट्रॉन देता है उस पर धन-आवेश आ जाते हैं। इस प्रकार, ये दो विपरीत आवेशवाले आयन एक-दूसरे से स्थिर विद्यृतीय आकर्षण-बल द्वारा जुटकर अणु बनाते हैं। जिस आयन पर धन-आवेश रहता है वह धनायन और जिस पर ऋण-आवेश रहता है वह ऋणायन कहलाता है।आयनी यौगिकों के निर्माण का ऊर्जा विज्ञान
हमने इलेक्ट्रॉन के स्थानांतरण से आयनिक यौगिक (NaCl) के निर्माण का वर्णन पढ़ा। जब क्लोरीन परमाणु क्लोराइड आयन बनने में कम ऊर्जा उत्सर्जित (इलेक्ट्रॉन बंधुता एन्थैल्पी) होती है और सोडियम परमाणु से सोडियम आयन बनने में अधिक ऊर्जा अवशोषित (आयनन एन्थैल्पी) होती है, तो आप कैसे कह सकते हैं कि NaCl निर्माण से ऊर्जा में कमी होती है ? आइए आपके संशय को मिटाने के लिए पूरे प्रक्रम को ध्यान से देखें। सोडियम और क्लोरीन से NaCl के निमार्ण को क चरणों में देखा जा सकता है।जैसे -
अ. पूर्ण ऊष्मा ऊध्र्वपातन- ठोस सोडियम से गैसीय सोडियम परमाणु
NA(S)→NA(g) H=108.7kjmol-1
ब. आयनन एन्थैल्पी- गैसीय सोडियम परमाणु से सोडियम आयन
NA(S)→NA+(g)+e- H=493.8kjmol-1
स. वियोजन ऊर्जा- गैसीय क्लोरीन अणु से क्लोरीन परमाणु
1/2 CI2(g)→CI(g) H=-120.9kjmol-1
द. गैसीय क्लोरीन परमाणु का क्लोराइड आयन में परिवर्तन (इलेक्ट्रॉन का संकलन)
CI(g)+e-→CI- (g) H=-379.5kjmol-1
इ. सोडियम और क्लोराइड आयन से NaCl निर्माण (क्रिस्टल या जालक का बनना)
Na+(g)+CI- (g)→Na+CI-(S) H=-754.8kjmol-1
इस चरण में उत्सर्जित ऊर्जा जालक ऊर्जा कहलाती है। नैट क्रिया होगी
Na+(s)+1/2CI- (g)→Na+CI- (S) H=--410.9kjmol-1
संभवन की पूर्ण ऊष्मा में परिर्वतन का परिकलन अन्य ऊर्जाओं का योग में परिवर्तन को लेकर किया जा सकता है।
H=(180 .7+493.8+120.9-379.5-754.8)=--410 .9kjmol-1
अत: हम देख सकते हैं कि सोडियम और क्लोरीन से NaCl बनने का प्रक्रम ऊर्जा को काफी कम कर देता है। यह युक्ति ऊर्जा के संरक्षण नियम का पालन करती है और यह बार्न हॉबर चक्र कहलाती है।
इसमें सम्मिलित पाँच विभिन्न प्रकार की ऊर्जाओं मेंं से दो (पूर्ण ऊष्मा ऊध्र्वपातन और वियोजन ऊर्जा) का मान बाकियों से कम होता है। इसलिए बाकी तीन ऊर्जा- आयनन एन्थैल्पी, इलेक्ट्रान बन्धुता और जालक ऊर्जा एक आयनिक यौगिक के बनने में महत्वपूर्ण भूमिका निभाती हैं। उपर्युक्त चर्चा के बाद हम कह सकते हैं कि आयनिक यौगिकों का बनना सुगमता से सम्भव होता है। यदि-
- धातु की कम आयनन एन्थैल्पी हो
- दूसरे तत्व की इलेक्ट्रान बंधुता अधिक हो (अधातु की इलेक्ट्रॉन ग्रहण एन्थैल्पी)
- जालक ऊर्जा अधिक हो
विद्युत संयोजी यौगिकों के गुण-
- सामान्यत: विद्युत संयोजी यौगिक पानी में घुलनशील होते हैं।
- विद्युत संयोजी यौगिकों के गलनांक तथा क्वथनांक बहुत ऊंचे होते हैं। क्योंकि इनमें दो आयन आपस में प्रबल विद्युत आकर्षण बल द्वारा बंधे होते हैं। अत: आकर्षण बल रेखाओं को तोड़ने के लिए अधिक ऊर्जा की आवश्यकता पड़ती है।
- विद्युत संयोजी यौगिक जल में घुलने पर अथवा पिघली अवस्था मेंं आयनित हो जाते है।
- ये प्राय: विद्युत के सुचालक होते हैं।
- विद्युत संयोजी यौगिक आयनिक अभिक्रियाएं देते है, जो तीव्रगामी होते है।
वैद्युत संयोजक बंध कब बनते हैं?
- जब प्रबल धन विद्युती तत्व (वर्ग I, II, III) किसी प्रबल ऋण विद्युती तत्व (वर्ग VI, VII) के साथ संयोग करता है।
- जब दो संयोजी तत्वों की विद्युत ऋणात्मकताओं में अंतर होता हैं।
- जब एक तत्व आसानी से इलेक्ट्रॉन त्यागकर तथा दूसरा आसानी से इलेक्ट्रॉन ग्रहण करके उत्कृष्ट गैस की संरचना प्राप्त करता है।
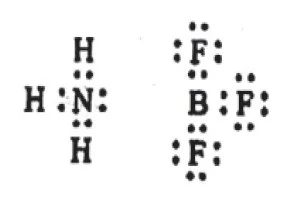
लुइस संरचना-
इस सरंचना में परमाणु में उपस्थित संयोजकता इलेक्ट्रॉन को दर्शाने के लिए इलेक्ट्रॉन बिन्दु प्रतीक या लुइस प्रतीक का उपयोग किया जाता है। इस विधि में परमाणु के बाह्य कोश मेंं उपस्थित इलक्े ट्रॉनो को दर्शाने के लिए उस तत्व के प्रतीक के चारों ओर उतने ही बिंदु लगा देते हैं, जितने इलेक्ट्रॉन उसके बाह्य कोश मेंं उपस्थित रहते है।सहसंयोजक आबंध -
सहसंयोजक बंधन परिभाषा-
जब दो सदृश या असदृश परमाणु अपने बाह्यतम शेल के इलेिक्ट्रॉनों का आपस में साझा करके संयोग करते हैं तब उनके बीच स्थित बंधन को सहसंयोजक बंधन कहते हैं तथा इस प्रकार से निर्मित यौगिक सहसंयोजक यौगिक कहलाता है। ये परमाणु इलेक्ट्रॉनों की साझेदारी द्वारा अपना अष्टक पूरा करके स्थायित्व प्राप्त करते हैं। जब दो परमाणु एक-एक इलेक्ट्रॉन का साझा करते हैं तब एक सहसंयोजक बध्ंनबनता है। जब दो परमाणु दो-दो इलेक्ट्रॉन का साझा करते है। तब एक सहसंयोजक बध्ं ान बनता है। जिस द्विबंधन कहते हैं। इसी प्रकार, जब दो परमाणु तीन-तीन इलेक्ट्रानों का साझा करते है तब तीन सहसंयोजक बंधन बनते है जिसे त्रिबंधन कहते है ।सहसंयोजी बंध के प्रकार-
सहसंयोजी बंध दो प्रकार के होती है।- अध्रुबीय सहसंयोजक बंध- जब सहसंयोजक बंध दो सदृश परमाणुओं के बीच होता है इसमें दोनों परमाणुआ ें की विद्युत ऋणात्मकता एक ही होती है। अत: साझा में भाग लेने वाले इलेक्ट्रॉन अणु में समगित रूप हो वितरित रहते है। उदाहरण- हाइड्रोजन का बनना H--H→H:H
- ध्रवीय सहसंयोजक बंध- वे सहसंयोजक बंध जो असमान ऋणाविधुतताओं वाले परमाणुओं के मध्य बनते है धु्रवीय सहसंयोजक बंध कहलाते है इस बंध में भाग लेने वाले इलेक्ट्रॉन दोनों परमाणुओं से असमान दूरी पर रहते है। इस कारण एक परमाणु पर आंशिक धनावेश (S+) तथा दूसरे पर आंशिक ऋणावेश (s-) उत्पन्न हो जाता है। उदाहरण- हाइड्रोजन क्लोराइड का अणु-हाइड्रोजन क्लोराइड के अणु में हाइड्रोजन और क्लोरीन परमाणुाओं के बीच एक जोड़ा इलेक्ट्रॉन रहते हैं। इनमें एक इलेक्ट्रॉन हाइड्रोजन परमाणु से और दूसरा क्लोरीन परमाणु से आता है। किंतु क्लोरीन परमाणु, हाइड्रोजन की अपेक्षा बहुत अधिक विद्युत-ऋणात्मक होता है, अत: इलेक्ट्रॉनों की यह जोड़ी हाइड्रोजन की अपेक्षा क्लोरीन परमाणु की ओर अधिक खिंची हु रहती है।
अधु्रवीय अणु वैद्युत क्षेत्र में किसी खास दिशा की ओर निर्देशित नहीं रहते हैं।
इनका द्विधु्रव-आघूर्ण शून्य होता है।
सह-संयोजी यौगिकों के गुण-
- सामान्य: सह संयोजी यौगिक जल में अघुलनशील होते हैं।
- इनके गलनांक एवं क्वथनांक के मान प्राय: कम होते हैं।
- सह-संयोजी यौगिक विद्युत के कुचालक होते हैं।
- सह-संयोजी यौगिक की आण्विक अभिक्रियाएं मंद गति से होती हैं।
- सह-संयोजी यौगिकों का विलयन में अथवा पिघली अवस्था में आयनीकरण नहीं होता है।
उपसहसंयोजक बंधन -
उपसहसंयोजक - उपसहसंयोजक बंधन का निर्माण दो भिन्न प्रकार के परमाणु या
आयन के बीच होता है, जिसमें एक प्रदाता और दूसरा स्वीकारक कहलाता है। प्रदाता के
पास इलेक्ट्रॉनों की एक या दो निर्जन जोड़ी रहती है जिसे वह स्वीकारक को देकर
उपसहसंयोजक बंधनवाले यौगिक की रचना करता है। प्रदत्त इलेक्ट्रॉन पर दोनों
परमाणुओं का अधिकार हो जाता है और यौगिक अपने को स्थायी बना लेते हैं। अत:
उपसहसंयोजक बंधन वह है जो दो परमाणुओं के बीच एक इलेक्ट्रॉन जोडी़ के
साझे से बनता है, कितु यह इलेक्ट्रॉन-जोड़ी़ सिर्फ एक ही परमाणु द्वारा प्रदत्त होती है।
प्रदाता से स्वीकारक की ओर एक तीर-चिह्र दिया जाता है। इसका मतलब है कि
बंधन में भाग लेनेवाले दोनों ही इलेक्ट्रॉन केवल एक परमाणु (प्रदाता) द्वारा दिए गए हैं।
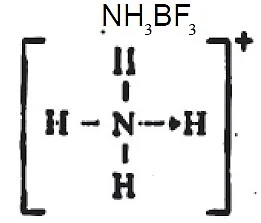
उदाहरण- (i) NH3 और BF3के बीच अभिक्रिया होने पर बोरन ट्राइफ्लोराइड अमोनिया बनता है। NH3 और BF3 की इलेक्ट्रॉनिक रचना देखने पर पता चलता है कि
NH3 के Nपरमाणु के पास इलेक्ट्रॉनों की एक निर्जन जोड़ी है, किन्तु BF3 के B परमाणु
की बाहा्र कक्षा में केवल छ: इलेक्ट्रॉन हैं।
इस अभिक्रिया में होता यह है कि अमोनिया का N परमाणु अपने इलेक्ट्रॉनों की
निर्जन जोड़ी का B परमाणु के साथ साझा करता है। इससे BF3 में B परमाणु की बाहा्र
कक्षा में इलेक्ट्रॉनों की संख्या 8 हो जाती है, जिससे इसकी रचना नियॉन गैस की
इलेक्ट्रॉनिक रचना की तरह होकर स्थायी बन जाती है।
अत: NH3BF3 में N और B परमाणुओं के बीच उपसहसंयोजक बंधन है।
(ii) अमोनियअमोनियम क्लोराइड के अणु का निर्माण- अमोनिया के N परमाणु के
इलेक्ट्रॉनों की निर्जन जोड़ी हाइड्रोजन क्लोराइड के हाइड्रोजन आयन को दी जाने पर
अमोनियम आयन (NH4+) बनता है। इस क्रिया में H और Cl के बीच का बंधन टूट जाता
है।
उपसहसंयोजक यौगिकों के गुण -
- उपसहसंयोजक बंधन दृढ़ और दिशात्मक होता है।
- इसके यौगिक के अणु में परमाणु प्रदत्त इलेक्ट्रॉनों द्वारा दृढ़ता से एक-दूसरे से जुटे रहते है; अत: ये यौगिक जल में घोले जाने पर या द्रवित किए जाने पर वियोजित नहीं होते है।
- ये जल में प्राय: अविलेय, किंतु कार्बनिक विलायकों में विलेय होते है।
- इन यौगिकों के द्रवणांक और क्वथनांक वैद्युत संयोजक यौगिकों की अपेक्षा प्राय:कम और सहसंयोजक यौगिक की अपेक्षा प्राय: अधिक होते है। की अपेक्षा प्राय:कम और सहसंयोजक यौगिक की अपेक्षा प्राय: अधिक होते है।
हाइड्रोजन बन्धन -
जब हाइड्रोजन परमाणु किसी प्रबल विद्युत-ऋणात्मक तत्वों जैसे-O, N, F, S
आदि से सहसंयोजक बन्ध द्वारा जुड़ा रहता है, तब सहसंयोजक बन्ध बनाने वाला
इलेक्ट्रॉनों का जोड़ा इन विद्युत-ऋणात्मक तत्वों के अधिक पास रहता है, जिससे H
परमाणु पर थोड़ा धन आवेश आ जाता है। धन आवेश युक्त यह H परमाणु किसी प्रबल
विद्युत्-ऋणात्मक तत्व के साथ एक दूसरा बन्ध बनाने की क्षमता रखता है। ऐसे बन्ध को
हाइड्रोजन बन्ध या हाइड्रोजन सेतु कहते हैं। हाइड्रोजन बन्ध, हाइड्रोजन परमाणु व
विद्युत्-ऋणी परमाणु (O, N, F) के मध्य आकर्षण बल है।
ऐसा हाइड्रोजन बंधन जल तथा के अणुओं में भी उपस्थित रहता है।
H2S अणुओं के बीच हाइड्रोजन बंधन नहीं रहता, क्योकि की विद्यतु -ऋणात्मकता
का मान उतना अधिक नहीं होता। जिससे इस अणु में आवेश-बिलगाव ज्यादा नहीं हो
पाता। यही कारण है कि साधारण अवस्था में जल द्रव रूप में रहता है, जबकि H2S
गैसीय रूप में।
हाइड्रोजन बंधन एक कमजोर स्थिर वैद्युत आकर्षण-बल है, जो सहसंयोजक बंध्
ान से कमजोर होता है। अत: F.....H बंधन H-F बंधन से कमजोर होता है।
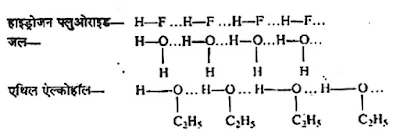
हाइड्रोजन बंधन की उपस्थिति के ही कारणHF, H2O, NH3 आदि बहुलक रूप
में रहते है; यथा- (HF)x, (H2O)n, (NH3)x द्रवणांक ओर क्वथनांक चूँकि आणविक
द्रव्यमान पर निर्भर करते हैं, इसलिए यौगिको के द्रवणांक और क्वथनांक उच्च होते हैं।
हाइड्रोजन बन्ध बनने की शर्तें -
हाइड्रोजन बन्ध बनने के लिए निम्नलिखित शर्तें आवश्यक हैं-
इस बिन्दुकित रेखा द्वारा प्रदर्शित करते हैं। के अनेक अणु आपस में जुड़कर एक संगुणित अणु बना लेते है।। इसी प्रकार जल और ऐल्कोहॉल के अनेक अणु हाइड्रोजन बन्ध द्वारा जुड़े रहते हैं।
हाइड्रोजन बन्ध एक दुर्बल बन्ध होता है। इसकी ऊर्जा 5 किलो-कैलोरी होती है,
जबकि सामान्य सहसंयोजक बन्ध की ऊर्जा 50-100 किलो-कैलोरी होती है।
वेस्पर सिद्धांत के मुख्य बिन्दु इस प्रकार है-
- उच्च विद्युत-ऋणात्मकता-अणु में को एक परमाणु उच्च विद्युत-ऋणात्मक होना चाहिए।
- छोटा आकार- विद्युत-ऋणात्मक तत्व का आकार छोटा होना चाहिए।
हाइड्रोजन बन्ध के प्रकार -
- अन्तर-अणुक हाइडोजन बन्ध- जब हाइड्रोजन और विद्युत-ऋणात्मक तत्व परमाणु दो भिन्न-भिन्न अणुओं में उपस्थित हो तब इस प्रकार बने H-बन्ध को अन्तर-अणुक हाइड्रोजन बन्ध कहते हैं; जैसे- H2O, HF, C2H5OH आदि।
इस बिन्दुकित रेखा द्वारा प्रदर्शित करते हैं। के अनेक अणु आपस में जुड़कर एक संगुणित अणु बना लेते है।। इसी प्रकार जल और ऐल्कोहॉल के अनेक अणु हाइड्रोजन बन्ध द्वारा जुड़े रहते हैं।
हाइड्रोजन फ्लुओराइड-
- अन्त:अणुक हाइड्रोजन बन्ध- हाइड्रोजन और विद्युत ऋणात्मक तत्व परमाणु दोनों ही जब एक ही अणु में उपस्थित हों, तब इस प्रकार बने H-बन्ध को अन्त अणुक हाइड्रोजन बन्ध कहते हैं; जैसे- o-नाइट्रोफीनॉल, ऐसीटो ऐसीटिक एस्टर इत्यादि में-
संयोजकता कोश इलेक्ट्रॉन युग्म प्रतिकर्षण सिद्धांत-
VSEPR सिद्धात- अणुओं या आयनों की लुइस संरचनाओं से उनकी ज्यामिति आकृति का अनुमान करने मैं संयोजकता कोश इलेक्ट्रॉन युग्म प्रतिकर्षण सिद्धांत अर्थात् वेस्पर (VSEPR) सिद्धांत बहुत महत्व पूर्ण एवं उपयोगी है। यह सिद्धांत सिजविक एवं पॉवले ने प्रस्तुत किया और गिलस्े पी व नाइहामे ने संशोधन किये। यह सिद्धातं सहसंयोजक अणु बनने पर संयोजकता कोश में बने इलेक्ट्रॉन युग्मों का आपस में प्रतिकर्षण का अणु ज्यामिति पर प्रभाव स्पष्ट करता है। इस सिद्धांत के अनुसार ‘‘किसी अणु के केन्द्रीय परमाणु के संयंयोजेजेजकता कोश मे उपास्थित इलेक्ट्रान युग्म से भरे हुए कक्षक त्रिविम में इस प्र्रकार व्यवस्थित होते है कि उनके मध्य न्यूनतम प्रतिकर्षण (अधिक स्थायित्व) हो।’’वेस्पर सिद्धांत के मुख्य बिन्दु इस प्रकार है-
- सहसंयोजक बंध का निर्माण इलेक्ट्रॉन के साझे के फलस्वरूप होता है।
- किसी रासायनिक बंध में अभिकारकों के बाह्म आर्बिटल के इलेक्ट्रॉनों के मध्य अन्त: क्रिया होती है।
- बाक्ष कोश के वे इलेक्ट्रॉन जो बंधन में भाग लेते है, बंधी इलेक्ट्रान युग्म कहलाते है तथा वे इलेक्ट्रॉन जो बंधन में भाग नहीं लेते अबंध्ंधी इलेक्ट्रॉन युुग्म या बंधहीन कहलाते है।
- केन्द्रीय परमाणु के बाह्यतम कोश में उपस्थित बंधित एवं बंधहीन या अबंधित इलेक्ट्रॉन के योगफल को संयोजकता कोश इलेक्ट्रॉन कहते है।
- बन्धी इलेक्ट्रॉन युग्म तथा बंधहीन इलेक्ट्रॉन युग्मों के मध्य आपस में प्रतिकर्षण होने के कारण अणु वह ज्यामितीय विन्यास प्राप्त करने का प्रयास करता है, जिससे इन इलेक्ट्रॉन युग्मॉ के बीच अधिकतम दूरी हो।
- अणु या आयन मे केन्द्रीय परमाणु के चारो ओर इलेक्ट्रॉन युग्मों की व्यवस्था संयोजकता कोश में उपस्थित बंधी और अबंधी इलेक्ट्रॉन युग्मों की कुल संख्या पर निर्भर करती है।
Lone pair-lone pair > Lone pair-bond pair > Bond pair-bond pair
सारिणी मेंं दिए गए अणुओ की आकृतियां उन अणुओं के संगत है। जिनमें केवल
आबंध युग्म है।
केंद्रीय परमाणु के चारों ओर इलक्ट्रॉन युग्मों की ज्यामितीय व्यवस्था -
आइए उदाहरण के लिए तीन अणु लें- मीथेन, अमोनिया और पानी तीनों के लिए केंद्रीय
परमाणु के चारों ओर 4 इलेक्ट्रॉन युग्म होते हैं, परन्तु इन चार युग्मों की प्रकृति इन तीनोंं
अणुओं में भिन्न है मीथेन अणु के केंद्रीय परमाणु कार्बन में 4 संयोजकता इलेक्ट्रॉन हैं और
यह चार इलेक्ट्रॉन चार हाइड्रोजन परमाणुओं के साथ सहभाजन करता है। अत: इसमें
चार आबधं युग्म है। और सरणी 5.1 के अनुसार इसकी आकृति चतुष्फलकीय होनी चाहिए।
अमोनिया में ंभी चार इलेक्ट्रॉन युग्म हैं पर उनकी प्रकृति भिन्न हैं। इसमें से तीन
आबंध युग्म हैं और एक एकक युग्म इसी प्रकार पानी में भी चार इलेक्ट्रॉन युगम हैं- दो
आबंध युग्म और दो एकक युग्म आबंध-युग्म-आबंध युग्म और एकक युग्म-आबंध युग्म
के बीच आपसी प्रतिकर्षण की मात्रा भिन्न होने के कारण अणुओं की आकृति आपेक्षित
चतुष्फलकीय से कुछ विकृत होगी इन तीन अणुओं के इलेक्ट्रॉन युग्मों की संख्या उनकी
प्रकृति और आकृति सारणी में दी ग है-
सारणी चार इलेक्ट्रॉन युग्मों वाले अणुओं की आण्विक ज्यामितियाँ जिनमें एकाकी युग्मों
और आबंध युग्मों के विभिन्न संयोजन है-
संयोजकता बन्ध सिद्धान्त -
संयोजकता बन्ध सिद्धान्त सर्वप्रथम सन् 1927 में हिटलर और लण्डन ने दिया था,
जिसे पॉलिंग एवं स्लेटर ने सन् 1930 में आधुनिक स्वरूप प्रदान किया था। इसके लिए
उन्हें सन् 1954 में नोबल पुरस्कार प्राप्त हुआ। यह सिद्धान्त अग्रलिखित तथ्यों पर
आधारित है-
- इस सिद्धान्त के अनुसार परमाणुओं के मध्य सहसंयोजक बंध उनके संयोजकता कोश के अर्द्धपूरित परमाणु ऑर्बिटलों के आंशिक अतिव्यापन से बनते हैं।
- अतिव्यापन में भाग लेने वाले परमाणु ऑर्बिटलों में विपरीत चक्रण वाले इलेक्ट्रौन स्थित हों।
- बन्ध की प्रबलता अतिव्यापन की सीमा पर निर्भर होती है अधिक अतिव्यापन होन पर प्रबल बन्ध बनता है।
- अतिव्यापन तथा इलेक्ट्रॉन के युग्मन के फलस्वरूप ऊर्जा मुक्त होती है तथा निकाय (आण्विक अवस्था) निम्न ऊर्जा अवस्था (अधिकतम स्थायित्व) को प्राप्त कर लेता है।